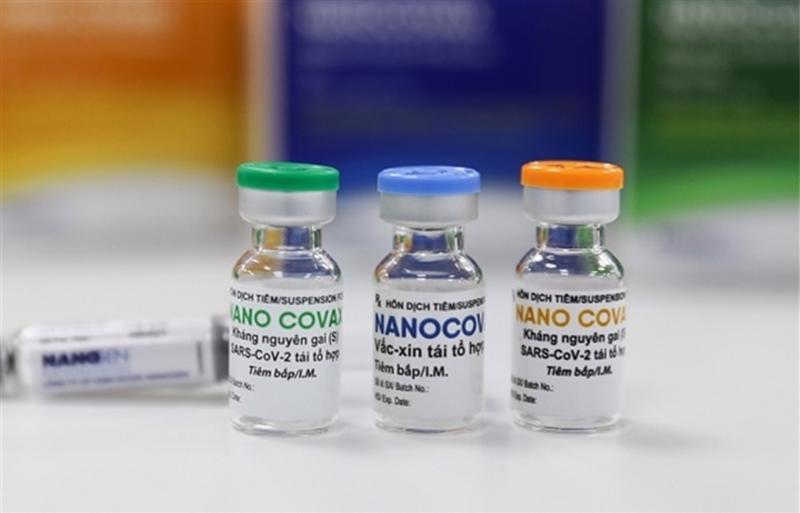
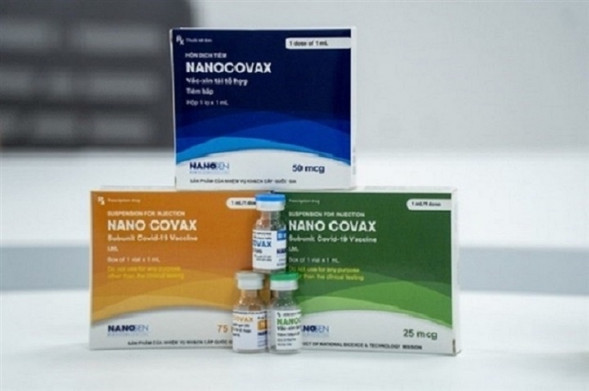
Nanocovax trước cơ hội được cấp phép có điều kiện
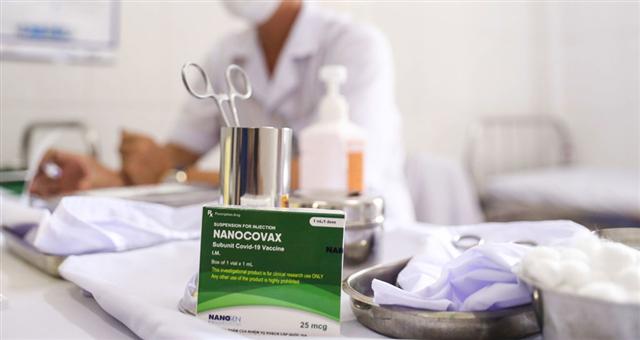
Chiều 18.9, Hội đồng Đạo đức trong nghiên cứu y sinh quốc gia đã họp, đánh giá và thông qua hồ sơ nghiên cứu thử nghiệm lâm sàng vắc xin Covid-19 “made in Vietnam” Nanocovax.
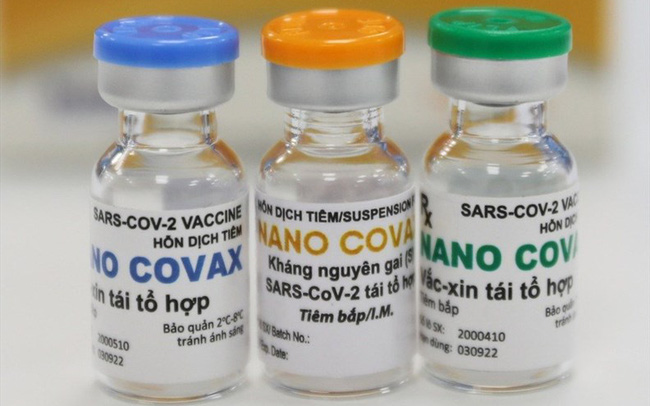
Hội đồng Đạo đức quốc gia đã thông qua hồ sơ nghiên cứu thử nghiệm lâm sàng vắc xin Nanocovax. Ảnh: GIA HÂN
|
Theo yêu cầu trước đó (ngày 29.8) của Hội đồng Đạo đức, nhóm nghiên cứu đã bổ sung các dữ liệu để đủ điều kiện xem xét cấp phép khẩn cấp. Trong đó, có bổ sung về dữ liệu tính an toàn, sinh miễn dịch, hiệu quả bảo vệ. Trong đó, về tính sinh miễn dịch, nhóm nghiên cứu bổ sung, cập nhật đánh giá tính sinh miễn dịch trên các biến chủng mới như biến chủng Delta…Vắc xin này do Công ty Nanogen (TP.HCM) nghiên cứu, phát triển. Trao đổi với PV Thanh Niên, GS Trương Việt Dũng, Chủ tịch Hội đồng Đạo đức trong nghiên cứu y sinh quốc gia (gọi tắt: Hội đồng Đạo đức), cho biết hồ sơ thử nghiệm lâm sàng vắc xin Nanocovax báo cáo cơ bản đạt yêu cầu. Tuy nhiên, Bộ Y tế sẽ công bố chính thức, cụ thể về kết quả này.
Việc được thông qua hồ sơ nghiên cứu thử nghiệm lâm sàng là yêu cầu quan trọng, để Hội đồng Đạo đức và Hội đồng Tư vấn cấp giấy đăng ký lưu hành thuốc, nguyên liệu làm thuốc (Hội đồng Cấp phép) đánh giá khả năng cấp phép cấp bách cho vắc xin này.
Trước đó, thông tin cụ thể về các ứng viên vắc xin Covid-19 tiềm năng, TS Nguyễn Ngô Quang, Phó cục trưởng Cục Khoa học công nghệ – Đào tạo (Bộ Y tế), cho biết từ nay đến cuối năm, VN sẽ có ít nhất 1 vắc xin Covid-19 được cấp phép khẩn cấp và triển khai tiêm trong nước từ đầu năm 2022; vắc xin này hiện đã hoàn tất thử nghiệm lâm sàng giai đoạn 3 với 13.000 người tình nguyện tham gia nghiên cứu.
Theo thông tin từ nhóm nghiên cứu, thử nghiệm lâm sàng vắc xin Nanocovax: Kết quả ngày thứ 42 sau tiêm mũi 1 của 1.000 người trong nghiên cứu 3a cho thấy: 100% đối tượng được tiêm Nanocovax có kháng thể trung hòa Surrogate (khả năng trung hòa các độc tố, vi khuẩn và vi rút) trên ngưỡng 30%; 99,2% đối tượng chuyển đổi huyết thanh của kháng thể IgG kháng Protein S (sinh kháng thể), cao gấp 4 lần so với nền…
Song song với việc xin cấp phép sử dụng khẩn cấp có điều kiện, vừa qua Công ty Nanogen kiến nghị Bộ Y tế, Hội đồng Đạo đức xem xét việc triển khai nghiên cứu giai đoạn 3c (tiêm vắc xin Nanocovax cho khoảng 500.000 – 1 triệu người) và cho triển khai nghiên cứu trên trẻ em từ 12 đến dưới 18 tuổi sau khi được cấp phép.
Vắc xin Nanocovax được sản xuất trên công nghệ protein tái tổ hợp. Ưu điểm lớn nhất của vắc xin Nanocovax là tạo được đáp ứng miễn dịch tốt, độ an toàn cao, ít tác dụng phụ và có điều kiện bảo quản thuận lợi hơn so với các loại vắc xin khác (bảo quản 2 – 8 độ C). Nhà sản xuất cho biết năng lực sản xuất khoảng 10 triệu liều/tháng.
Theo quy định của Bộ Y tế tại Thông tư 11/2021/TT-BYT “Hướng dẫn đăng ký lưu hành vắc xin phòng Covid-19 trong trường hợp cấp bách”, vắc xin phòng Covid-19 sản xuất trong nước đang thực hiện thử nghiệm lâm sàng, nhưng đã có kết quả đánh giá giữa kỳ giai đoạn 3 về tính an toàn và hiệu quả bảo vệ của vắc xin dựa trên dữ liệu về tính sinh miễn dịch của vắc xin, thì được sử dụng để xem xét cấp giấy đăng ký lưu hành có điều kiện.
Trước khi thông qua hồ sơ nghiên cứu thử nghiệm lâm sàng chiều 18.9, Hội đồng Đạo đức quốc gia khuyến nghị: Trong trường hợp được cấp giấy đăng ký lưu hành, vắc xin Nanocovax có thể chỉ được sử dụng có điều kiện theo số lượng và kế hoạch được Bộ Y tế phê duyệt, những người sử dụng vắc xin này cần được theo dõi chặt chẽ về tính an toàn tương tự như với đối tượng nghiên cứu giai đoạn 3b. Vắc xin vẫn cần tiếp tục theo dõi, đánh giá về hiệu quả, hiệu lực, khả năng bảo vệ theo thời gian…
|
Bộ Y tế phê duyệt vắc xin Covid-19 Abdala Bộ Y tế vừa có Quyết định số 4471/QĐ-BYT (ngày 17.9) phê duyệt có điều kiện vắc xin Abdala cho nhu cầu cấp bách trong phòng chống dịch bệnh Covid-19. Theo Bộ Y tế, vắc xin Abdala được sản xuất thành phẩm, xuất bán thành phẩm, đóng gói cấp 2 tại Cuba. Trung tâm nghiên cứu, sản xuất vắc xin và sinh phẩm y tế (Polyvac), trực thuộc Bộ Y tế, là đơn vị đề nghị phê duyệt vắc xin này. Vắc xin Abdala mỗi liều 0,5 ml chứa 50 mcg vắc xin protein tái tổ hợp chứa vùng liên kết với thụ thể (RBG) của vi rút SARS-CoV-2, bào chế ở dạng hỗn dịch tiêm bắp. Vắc xin được đóng gói hộp 10 lọ, mỗi lọ chứa 10 liều. Bộ Y tế giao Viện Kiểm định quốc gia vắc xin và sinh phẩm y tế có trách nhiệm tiến hành kiểm định và cấp giấy chứng nhận xuất xưởng lô vắc xin Abdala trước khi đưa ra sử dụng. Abdala là vắc xin Covid-19 thứ 8 được phê duyệt sử dụng khẩn cấp phòng chống dịch tại VN. 7 vắc xin còn lại được phê duyệt từ tháng 2 đến nay gồm: AstraZeneca, Sputnik V, Sinopharm, Pfizer/BioNTech, Moderna, Janssen, Hayat-Vax. |




Phản hồi